
News
Wenn im Tumor das Licht angeht
30.09.2021 / Für seine Krebsforschung wird MDC-Doktorand Matthias Jürgen Schmitt mit dem Curt-Meyer-Gedächtnispreis der Berliner Krebsgesellschaft ausgezeichnet. Mit Hilfe „molekularer Reporter“ untersucht er, wie das Glioblastom – der tödlichste Gehirntumor überhaupt – resistent gegen Therapien werden kann.
Der mit 10.000 Euro dotierte Curt-Meyer-Gedächtnispreis der Berliner Krebsgesellschaft erinnert an Senatsrat Dr. Curt Meyer (1891-1984), der sich als Arzt und Gesundheitspolitiker zeitlebens für die Aufklärung, Vorsorge und Bekämpfung von Krebs eingesetzt hat. In diesem Jahr geht er an Matthias Jürgen Schmitt vom Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC). Die Preisverleihung findet am 1. Oktober 2022 im Rahmen der Jahrestagung der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie in Berlin statt.
„Zwar geht der Preis nominell an mich, aber es ist der Erfolg unseres ganzen Teams. Und es freut uns riesig, dass die Jury unsere Arbeit gewürdigt hat, in die wir viel Energie – und teilweise auch Frustrationen – gesteckt haben“, sagt Matthias Schmitt. „Auch in Hinblick darauf, dass die meisten Preisträger*innen in ihrer wissenschaftlichen Karriere viel weiter waren, sind wir stolz darauf, dass unser junges Labor ausgezeichnet wurde.“
Die Krux mit der Resistenz
Matthias Schmitt ist Doktorand in der MDC-Arbeitsgruppe „Molekulare Onkologie“ von Dr. Gaetano Gargiulo. Gemeinsam mit Yuliia Dramaretska und Juan Carlos Company Nevado hat er molekulare Reporter entwickelt, mit deren Hilfe er untersucht, wie es Glioblastomen gelingt, resistent gegen jegliche Therapie zu werden – und wie man dies verhindern könnte.
Um neue Therapieoptionen für diese Krebsform entwickeln zu können, müssen diese Resistenzmechanismen aufgeklärt werden. „In den vergangenen 20 Jahren kam kein einziges neues wirksames Medikament auf den Markt. Und das, obwohl keine andere Tumorart molekularbiologisch so gut charakterisiert ist“, betont Matthias Schmitt.
Das Problem: Die meisten Studien waren bisher auf die Biopsie und molekulare Charakterisierung des kompletten Tumors ausgerichtet. Die Zusammensetzung eines Glioblastoms ändert sich jedoch auf Einzellzellebene mit der Zeit. Insbesondere, wenn der Tumor nach zunächst erfolgreicher Therapie zurückkehrt. Dabei gehen die Tumorzellen häufig in den aggressivsten Subtyp über. Diesen „Identitätswechsel“ können molekulare Reporter nun sichtbar machen.
Leuchtsignale aus der Zelle
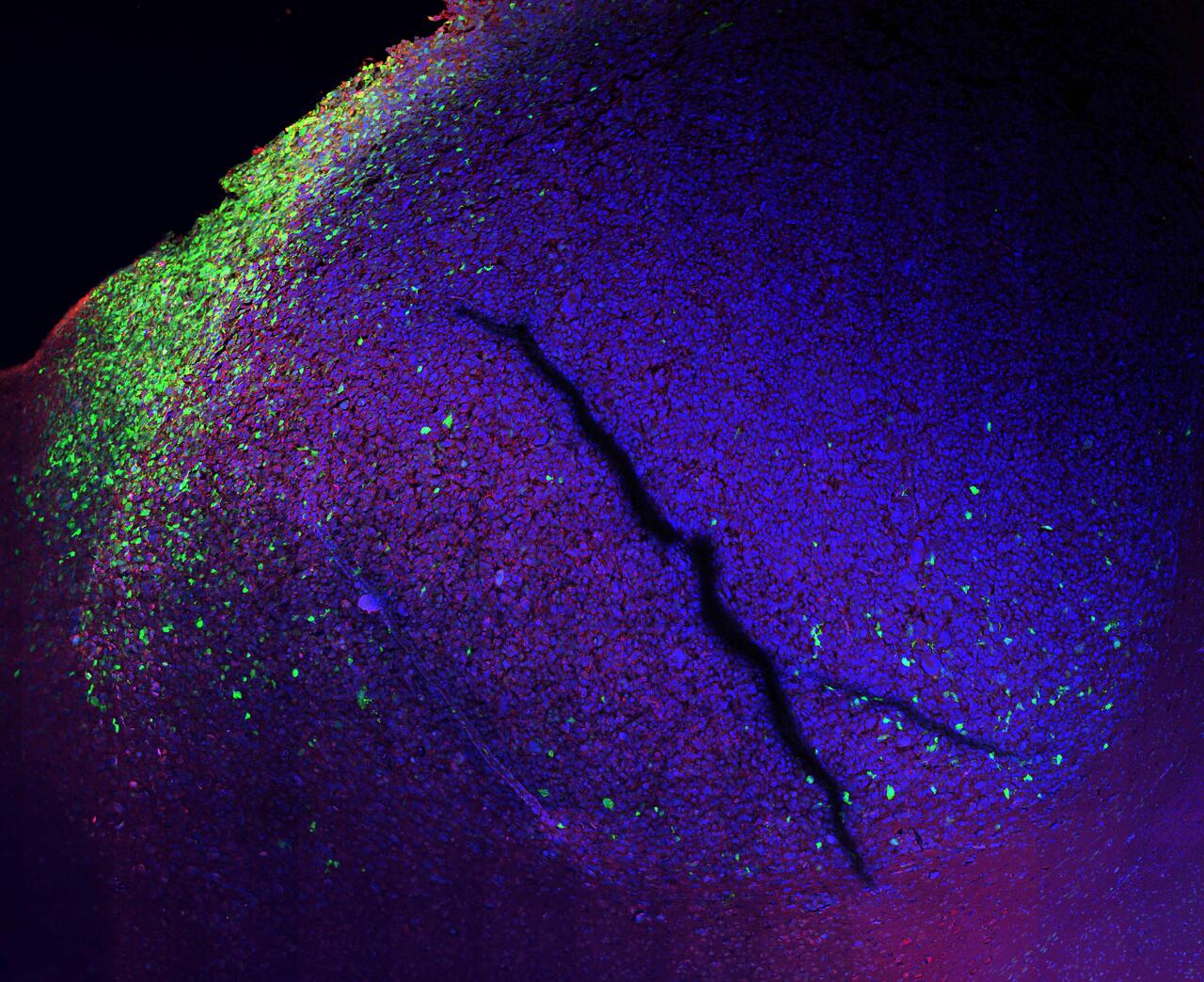
Molekulare Reporter sind synthetische Kopien von DNA-Sequenzen, welche die Aktivität jener Gene regulieren, die die Zellumwandlung in Gang setzen oder stoppen. „Wir haben quasi das komplette ,Regulatom‘ dieser Signaturgene in einem kleinen DNA-Stück zusammengefasst und mit einem fluoreszierenden Protein verknüpft“, erklärt der Molekularbiologe. „Wenn sich der Zellzustand ändert, werden bestimmte Transkriptionsfaktoren aktiv, binden an den entsprechenden Zielgenen – und an unseren Reporter. Und dann geht in der Zelle das Licht an.“
Die Ursprungszellen eines Glioblastoms entwickeln sich wahrscheinlich aus neuralen Stammzellen und aus Gliazellen, dem Stützgewebe des Gehirns. Dabei wachsen sie stark in umliegendes Gewebe ein. Allein in Deutschland erkranken jedes Jahr etwa 4.800 Menschen neu an diesem sehr aggressiven Tumor. Die Diagnose ist noch immer ein Todesurteil. Denn selbst nach anfänglich erfolgreicher Standardbehandlung – Entfernung des Tumors mit anschließender Bestrahlung und Chemotherapie – kehrt er unweigerlich zurück, und die Patient*innen sterben innerhalb weniger Monate. Medikamente, die bei anderen Krebsarten sehr erfolgreich sind, erreichen diesen Tumor in der Regel gar nicht, weil sie an der Blut-Hirn-Schranke scheitern.
Molekularer Reporter entlarvt Kollaborateure
Dank der neuen Einzelzelltechnologien wurde klar, wie heterogen ein Glioblastom ist. „Man hat gesehen, dass es viele unterschiedliche Zelltypen in verschiedenen Stadien gibt und es keine „One-fits-for-all“-Therapie geben kann“, erklärt Schmitt. Als wäre es nicht fatal genug, dass diverse genetische, epigenetische und transkriptionelle Faktoren bei der Resistenzentwicklung eine Rolle spielen – auch Zellen in der unmittelbaren Mikroumgebung des Tumors schalten sich ein.
Mit Hilfe der molekularen Reporter konnten Schmitt und seine Kolleg*innen unter anderem sichtbar machen, dass Zellen des angeborenen Immunsystems die Tumorzellen regelrecht verteidigen, anstatt sie zu bekämpfen. Sie helfen dabei, den Identitätswechsel hin zum aggressivsten Zellsubtyp zu ermöglichen, der maximal resistent gegen Therapien ist. „Wir wissen inzwischen: Greift man einen Zelltyp mit einer Chemotherapie an, verändert sich die Tumorzusammensetzung in einen anderen“, sagt Matthias Schmitt. „Ein möglicher Ansatz wäre, dieses Ausweichmanöver zu nutzen, um die Anzahl der Zellzustände zu reduzieren und den Tumor möglichst in den am wenigsten aggressivsten Typ hineinzudrängen.“
Die Forschenden können nun in Echtzeit verfolgen, wie einzelne Tumorzellen auf bestimmte Therapien reagieren. Das Team will herausfinden, ob und wie es möglich ist, die Immunzellen davon abzuhalten, die Tumorzellen zu unterstützen. Das Prinzip des aufblinkenden Reporters ist aber nicht nur bei Tumoren, sondern auch für viele andere biologische Fragestellungen anwendbar.
Weitere Preisträgerin: Dr. Laura Schmalbrock, Charité
Matthias Jürgen Schmitt teilt sich den diesjährigen Curt-Meyer-Gedächtnispreis mit Dr. Laura Schmalbrock von der Medizinischen Klinik mit Schwerpunkt Hämatologie, Onkologie und Tumorimmunologie der Charité – Universitätsmedizin Berlin. Sie wird für ihre Arbeit zur akuten myeloischen Leukämie (AML) ausgezeichnet, der am häufigsten auftretenden Form der akuten Leukämie bei Erwachsenen. Sie hat untersucht, warum manche Patient*innen auf eine bewährte Behandlungsmethode mit Tyrosinkinase-Inhibitoren in Kombination mit Chemotherapie nicht ansprechen oder warum sie einen Rückfall der Krankheit erleiden.
Weiterführende Informationen
- AG Gargiulo, Molekulare Onkologie
- Pressemitteilung: Molekulare Reporter stellen Verbündete des Hirntumors bloß
Literatur
Matthias Jürgen Schmitt, Carlos Company, Yuliia Dramaretska et al (2020): Phenotypic mapping of pathological crosstalk between glioblastoma and innate immune cells by synthetic genetic tracing, Cancer Discovery, DOI: 10.1158/2159-8290.CD-20-0219
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den MDC-Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 60 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organübergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das MDC fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC ) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am MDC arbeiten 1600 Menschen. Finanziert wird das 1992 gegründete MDC zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin. www.mdc-berlin.de
Foto: Bislang nur vermutet, dank des molekularen Reporters jetzt sichtbar gemacht: Wenn menschliche Tumorzellen und Hirnzellen einer Maus aufeinandertreffen, beginnen die Hirnzellen, sich zu verändern (grün).© Matthias Schmitt, MDC
Quelle: Pressemitteilung MDC
Wenn im Tumor das Licht angeht